Schilddrüsenerkrankungen in der Schwangerschaft KSW
Inhaltsverzeichnis- Begriffe und Abkürzungen
- Definition von Schilddrüsenfunktionsstörungen
- Schilddrüse und Schwangerschaft
- Screening-Indikation
- Hypothyreose
- Hyperthyreose
- Erweiterte fetale Diagnostik in der Schwangerschaft
- Postpartum Thyreoiditis (PPT)
- Plazentaschranke und Schilddrüse
- Symptome beim Neugeborenen
- Literatur
TSH: Thyroidea-stimulierendes Hormon oder Thyreotropin
fT4: freies Thyroxin
TPO-AK: Thyreoperoxidase-Antikörper
TRAK: Antikörper gegen TSH-Rezeptor der Thyreoidea-Drüsenepithelzellen
Latente Hypothyreose: TSH oberhalb des oberen Referenzbereichs bei normalen Werten für fT3 und fT4
Manifeste Hypothyreose: TSH oberhalb und fT4 unterhalb des Referenzbereichs
Latente Hyperthyreose: TSH erniedrigt bei Normalwerten für fT3 und fT4
Manifeste Hyperthyreose: TSH erniedrigt bzw. nicht mehr nachweisbar, bei erhöhten Werten für fT3 und/oder fT4
Hypothyroxinämie: TSH normwertig und fT4 5.–10. Perzentile des Referenzintervalls
Euthyreose: sämtliche Schilddrüsen-Parameter innerhalb des Referenzbereichs
Schilddrüse und Schwangerschaft
Physiologie
- In der Schwangerschaft kommt es zu einem deutlichen Mehrbedarf an maternalen Schilddrüsenhormonen
- Durch Hämodilution kommt es zu einem grösseren Verteilungsvolumen und zusätzlich muss die fetoplazentare Einheit versorgt werden.
- Bis zur 12. SSW steigt der Bedarf an Schilddrüsenhormonen um etwa ein Drittel, bis zur Mitte der Schwangerschaft um etwa 50% an.
- Im 1. Trimenon ist der Embryo abhängig von den maternalen Schilddrüsenhormonen, danach beginnt die fetale Schilddrüsenentwicklung. Erst um die 12.–14. SSW setzt die eigene Hormonproduktion ein, die im weiteren Schwangerschaftsverlauf zunimmt.
- Die grössten Veränderungen der Schilddrüsenfunktion in der Schwangerschaft:
- Ansteig des Thyroxin-bindenden Globins (TBG) durch steigende Östradiolspiegel die Produktion der freien Schilddrüsenhormone muss gesteigert werden Anstieg der Gesamtkonzentration an T4 und T3 im Serum, jedoch nicht an freiem T3.
- Stimulation des TSH-Rezeptors durch HCG aufgrund der Rezeptorhomologie zwischen TSH- und LH/beta HCG-Rezeptor
- Im 1. Trimenon stimuliert das stark erhöhte HCG den TSH-Rezeptor; dadurch steigen die fT3/fT4 Spiegel und gleichzeitig sinkt das TRH und TSH transient leicht ab (vorallem zwischen der 7. und 12. SSW)
- Im 2. Trimenon erneuter Anstieg der TSH-Werte durch die fallenden HCG Spiegel.
- Bei Vorhandensein von TPO-Antikörpern: geringerer HCG-induzierter Anstieg des fT4
Trimersterspezifische Normwerte
(American Thyroid Association, 2017)
Normbereich
TSH basal 0.16-4.25mlU/L
1. Trimenon 0,1- 4.0mlU/L
2. Trimenon 0,1- 4.2mlU/L
3. Trimenon 0,1- 4.2mlU/L
Idealerweise liegen lokale und trimenonspezifische Referenzwerte vor, die an gesunden und TPO‑AK-negativen Schwangeren mit normalen Jodwerten ermittelt wurden. In Ermangelung dieser Daten wird international aktuell ein oberer TSH-Grenzwert von 4,0 mU/l empfohlen.
Jod
- Jodmangel verstärkt bei der Mutter das Wachstum der Schilddrüse in der Schwangerschaft und kann beim Embryo/Fetus, wenn auch umstritten, negative Auswirkungen (z. B. Plazentahypotrophie, kleinerem neonatalen Kopfumfang, kindlichem Aufmerksamkeitsdefizit, kindlicher Hyperaktivität und neurokognitiven Defiziten) haben. Schwangeren und Stillenden wird nach wie vor eine Jodsupplementation empfohlen.
- Ein schwerer mütterlicher Jodmangel während der Schwangerschaft führt zu einer Verringerung der mütterlichen T4-Produktion, einer unzureichenden Plazentaübertragung von mütterlichem T4 und einer Beeinträchtigung der neurologischen Entwicklung des Fötus.
- Ein kindlicher protektiver Effekt einer Jodsupplementation wird allerdings in der Literatur kontrovers diskutiert.
- In der Schwangerschaft Zunahme des täglichen Jodbedarfs auf 200-300 µg (eine Nicht-Schwangere hat ein Bedarf von 150µg).
- Erhöhte renale Jodverluste (durch gesteigerte glomeruläre Filtration).
- Guidelines of the American Thyroid Association empfiehlt während der Schwangerschaft und Stillzeit eine Ergänzung mit 150 µg Jod pro Tag.
- Deutsche Gesellschaft für Ernährung (DGE), das Bundesinstitut für Risikobewertung (BfR) und der Arbeitskreis Jodmangel (AKJ): 100–150 µg Jod, ab 3 Monate vor Konzeption
- Schweizer Ernährungsbulletin, 2021: 150-200 µg
- Jodsubstitution auch bei Frauen mit Autoimmunthyreoiditis, auch in Stillzeit.
- Kontraindikation für Jodgabe: Hyperthyreose (M. Basedow bzw. Autonomie) und/oder signifikant erhöhte TRAK-Titer.
- Jodidhaltige-Multivitaminpräparate:
- Femibion, Burgerstein: 150 µg Jod
- Andreavit, Gynefam plus/Natalben plus 200 µg Jod
- Es ist kein generelles Screening empfohlen.
- Bestimmung bei anamnestischen Risikofaktoren (s.u.)
- Die indizierte Blutentnahme erfolgt idealerweise bei Feststellung der Schwangerschaft, optimal nicht später als in der 4.-6. SSW.
- weitere Kontrollen im Abstand von 4 bis 6 Wochen empfohlen.
- Die TSH-Werte sollten unter LT4-Behandlung zwischen 0,5-2,5 mU/l liegen.
- Nach der 20. SSW ist in der Regel keine weitere Kontrolle notwendig, da der Anpassungsprozess abgeschlossen ist und der Fetus zudem selbst in der Lage ist, Schilddrüsenhormon zu produzieren, ggf. nochmals in der 30. SSW
Indikation für TSH, fT4 bei:
- Frauen in Jodmangelgebieten
- Alter > 30 Jahre
- > 2 vorangegangene Schwangerschaften
- Schilddrüsendysfunktion in Anamnese
- Familienanamnese mit Schilddrüsendysfunktion
- Zustand nach Radiatio oder Operation im Halsbereich
- Abort oder Frühgeburt in der Vorgeschichte, Infertilität
- Amiodaron- oder Lithiumeinnahme, (kürzliche) Exposition mit jodhaltigem Kontrastmittel
- DM Typ 1 oder andere Autoimmunerkrankungen
- Symptome einer Hypo-/Hyperthyreose
- Struma
- BMI > 40 kg/m
- Schilddrüsenantikörpernachweis in der Vergangenheit
- Adipositas Grad 3
zusätzlich TPO-AK bei:
- unerfülltem Kinderwunsch/langjährigem Kinderwunsch
- bekannte erhöhte TPO-AK
- Hypothyreose
- TSH-Werten > 2,5mIU/l
zusätzlich TRAK-AK bei:
- Hyperthyreose
- St. n. Radiojodtherapie, St.n. Schilddrüsenoperation, anamnestisch Kind mit neonataler Hyperthyreose
zusätzlich Tg-AK bei:
- Hyper- oder Hypothyreose als zusätzliche Information
Häufigkeit in der Schwangerschaft
- Manifeste Hyperthyreose 0,4%
- Latente Hypothyreose 2-3%
Ätiologie
- Autoimmunthyreoiditis: Hashimoto-Thyreoiditis
- St.n. Thyreoidektomie oder Radiojodtherapie
- Extremer Jod oder Selenmangel
- Medikamentös induziert (z.B. Amiodaron, Lithium)
- Kongenital (z.B. angeborene Defekte in der SD-Hormon-Biosynthese)
Symptome/Klinik
- Leistungsminderung, Gedächtnisminderung, Schwäche, Antriebslosigkeit, Müdigkeit, Kälteempfindlichkeit, Gewichtszunahme trotz Appetitlosigkeit
- depressive Stimmung, trockene bzw. raue Haut, brüchiges Haar, Haarausfall
- raue Stimme, Obstipation, geschwollene Augenlider/Gesicht
- Bradykardie, verminderte RR-Amplitude
- Hyporeflexie
- Vor Schwangerschaft sekundäre Amenorrhö oder Zyklusstörungen
Diagnose
- Manifeste Hypothyreose: TSH basal > schwangerschaftsspezifischen Normwert und fT4 erniedrigt
- Erhöhte TPO-Antikörper bei Hashimoto-Thyreoiditis
Diagnosealgorithmus
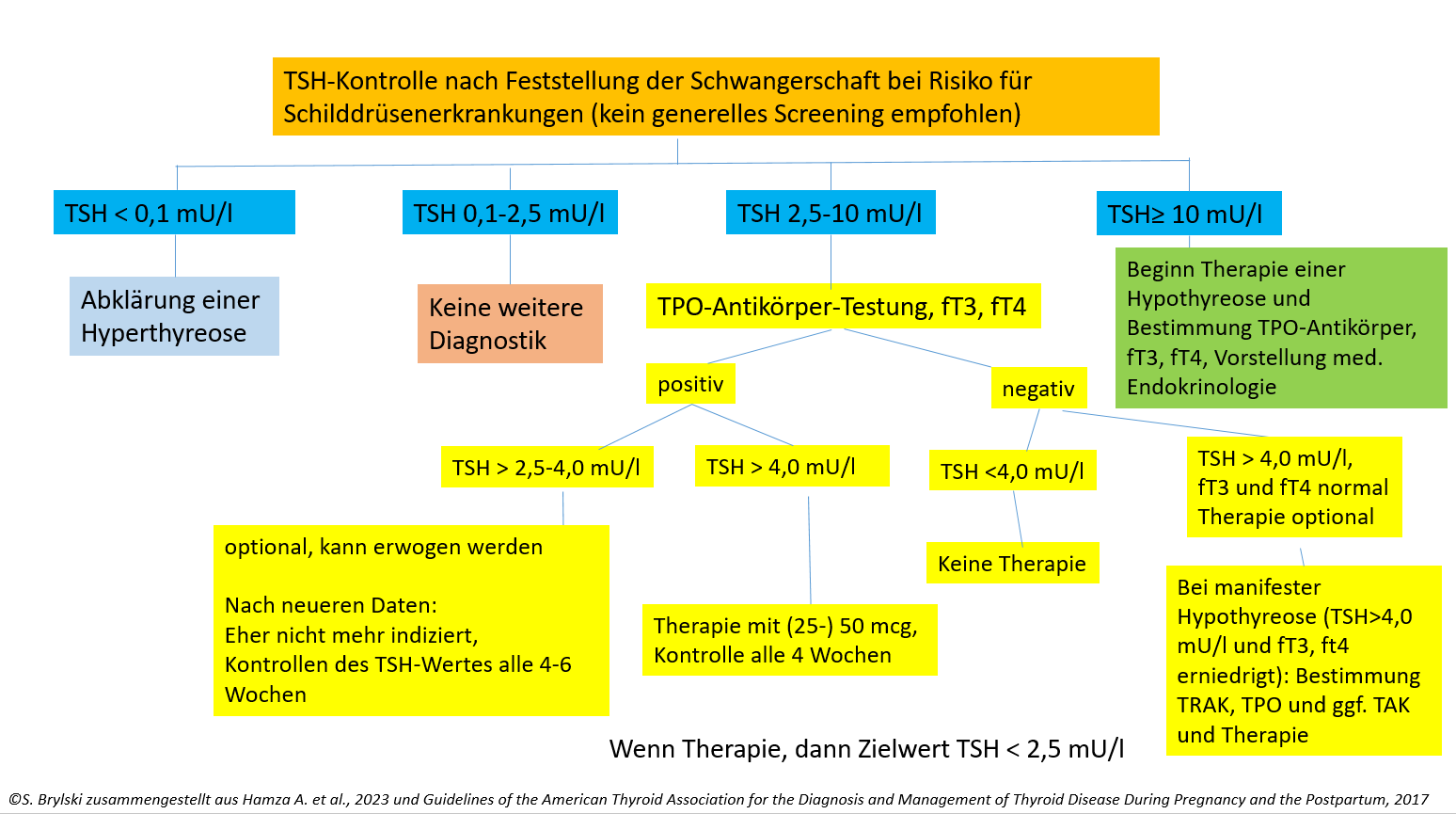
©Brylski zusammengestellt aus Hamza A. et al., 2023 und Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum, 2017
Risikoerhöhung
- Fehlgeburt
- Frühgeburtlichkeit
- niedriges Geburtsgewicht
- IUFT
- schwangerschaftsinduzierte Hypertonie
- Gestationsdiabetes
- Präeklampsie
- verminderte kindliche Intelligenz
- eine höhere Prävalenz von Asthma, Typ-1-Diabetes und Schilddrüsenerkrankungen
Latente Hypothyreose und Zusammenhang zu ungünstigem fetalen Outcome/geburtshilfliche Komplikation
- Widersprüchliche Studienlage hinsichtlich fetalem Outcome, neuere Daten können keinen Zusammenhang zwischen latenter Hypothyreose und o.g. Schwangerschaftskomplikationen aufzeigen.
- Im TSH-Bereich von 2,5 bis 4,2 mU/l gibt es keine Einschränkung der kindlichen Entwicklung, keine Auswirkungen auf das Fehlgeburtsrisiko
- Gewisse Studien konnten zeigen, dass bei TPO-positiven Schwangeren das hCG im ersten Trimenon zu einem deutlich geringeren Anstieg der fT4-Serumkonzentration und damit zu einer potenziellen Unterversorgung des Feten führt.
- Einige Studien zeigen ein erhöhtes Fehlgeburtsrisiko bei subklinischer Hypothyreose, v.a. bei TPO-Antikörperpositivität, andere nicht
- Eine Studie fand ein geringeres Abortrisiko bei Substitution einer subklinischen Hypothyreose, aber ein erhöhtes Risiko für Präeklampsie, Gestationsdiabetes und vorzeitige Entbindung (Maraka et al.,2017)
- Eine Studie mit 175 112 Frauen assoziiert niedrige TSH Werte (unter 0,8 mIU/l) mit vorzeitiger Entbindung und niedrigem Geburtsgewicht (Du et al., 2022)
Therapie
- Manifeste Hypothyreose
- Vorstellung Endokrinologie
- Levothyroxin (Eltroxin®-LF, Euthyrox®), meist Therapiebeginn mit 50 µg/d, abhängig vom TSH
- Einnahme 20-30 min vor dem Frühstück auf nüchternen Magen
- 4–5 Stunden vor Einnahme anderer Medikamente wie Vitamine, Kalzium oder Eisen
- Bei vorbestehender Hypothyreose ab positivem Schwangerschaftstest Dosiserhöhung um ca. 30-50% (z.b. am Wochenende doppelte Dosis). Weitere Dosisanpassung entsprechend TSH (Zielwert <2.5 mIU/l).
- Kontrolle alle 4 Wochen bis stabil, bis 20.SSW, dann nochmals in der 30.SSW
- behandelte SD-Erkrankungen brauchen kein zusätzliches Jodid
- Postpartum: Reduktion der fT4-Substitution auf Werte vor der Schwangerschaft mit TSH-Messung 4-6 Wochen p.p., CAVE: Postpartum-Thyreoiditis!
- Latente Hypothyreose
- Therapie zwingend wenn TPO-AK positiv und TSH über Referenzbereich, oder TPO-AK negativ und TSH > 10mU/l
- Therapie optional
- TPO-AK negativ und TSH 4.2-9.9 mU/L
- Therapie nicht indiziert wenn TPO-AK negativ und TSH innerhalb Referenzbereich
- Bei TPO-AK positiv und TSH innerhalb 2.5 mU/l-4.2 mU/l ist gemäss neuesten Daten (Dong et al., 2020 Van Diik et al., 2022, Wang et al, 2017) eine Therapie nicht mehr indiziert, aber zumindest regelmässige Kontrollen des TSH-Wertes (alle 4 Wochen), Therapie kann aber erwogen werden, allerdings keine Daten, dass die Gabe von L-Thyroxin zu einer Verbesserung der kindlichen kognitiven Funktion und Entwicklung führt. Und keine Daten, dass die Thyroxingabe zu einer Reduktion der Abortrate oder Erhöhung der Geburtenrate führt.
- Die Therapie eines hochnormalen TSH (> 2.5 mU/l-4mIU/l) ist nicht notwendig! Aktuell keine Evidenz.
- Besteht jedoch die Indikation zur Therapie, dann Zielwert TSH < 2.5 mU/l.
- Kenntnis der Genese der Hypothyreose wichtig. Kann genug funktionsfähiges Schilddrüsengewebe den Mehrbedarf in der Schwangerschaft decken?
- Bei Frauen ohne funktionsfähige Restschilddrüse scheint ein TSH zwischen den unteren Referenzwert und 1,2 mIU/l vorteilhaft zu sein.
Häufigkeit in der Schwangerschaft
- Manifeste Hyperthyreose 0.1-0.4%
- Latente Hyperthyreose 4%
Ätiologie
- M. Basedow
- Funktionelle Schilddrüsenautonomie (toxisches Adenom, Struma multinodosa)
- Hyperemesis gravidarum/ Schwangerschaftsassoziierte Hyperthyreose (selbstlimitierend)
- Iatrogen: Einnahme von Schilddrüsen-Hormonen bzw. Jod, jodhaltige Röntgenkontrastmittel, Amiodaron
- Passager im Rahmen einer de Quervain Thyreoiditis oder Hashimoto-Thyreoiditis
- Schilddrüsenkarzinom, Blasenmole, Chorionkarzinom (sehr selten)
Symptome/Klinik
- Nervosität, Reizbarkeit, Schlaflosigkeit, Heisshunger, Gewichtsverlust
- Wärmeintoleranz, Schwitzen, erhöhte Stuhlfrequenz
- Herzklopfen, Belastungsdyspnoe, diffuser Haarausfall
- Muskuläre Schwäche (v.a. Oberschenkel), gesteigerte Ermüdbarkeit
- Exophthalmus (in 60% bei M. Basedow), Struma (diffus oder knotig)
- Tachykardie, Herzrhythmusstörungen, arterielle Hypertonie, Hyperreflexie, Tremor
Diagnose
- TSH basal < 0,1 mIU/ L und fT4 erhöht
- M. Basedow: positive TRAK
- Ermöglicht Abgrenzung zur «Schwangerschafts-Hyperthyreose» im 1. Trimenon (durch hCG-Effekt), hier TRAK negativ
- Ultraschall: Schilddrüse vergrössert, inhomogen, echoarm, im Doppler verstärkte Durchblutung
- Auskultatorisch Schwirren über Struma
- Ggf. Feinnadelpunktion/ Zytologie zur weiteren Abklärung
Risikoerhöhung
- Abort, IUFT
- Frühgeburtlichkeit
- IUGR
- perinatale Morbidität und Mortalität
- fetale Herzinsuffizienz
- Präeklampsie, schwangerschaftsinduzierte Hypertonie
- thyreotoxische Krise
Latente Hyperthyreose: kein erhöhtes Risiko für Komplikationen
Therapie
- M. Basedow
- Vorstellung Endokrinologie
- 1.Trimenon: Propylthiouracil (PTU) 50-200mg 3x/d, CAVE: fulminante Hepatotoxizität!
- 2./3. Trimenon: Carbimazol 5-30mg 1x/d oder Thiamazol (5–15 mg/d) CAVE: Risiko von Malformationen (Aplasia cutis, Ösophagus- od. Rektusatresie, Bauchwanddefekten, Ventrikelseptumdefekten und fazialen Dysmorphien).
- Nur nach Durchführung einer strengen individuellen Nutzen-Risiko-Bewertung rezeptieren!
- Da Thyreostatika die Plazentaschranke effektiv überwinden, muss auf fetaler Seite bei kontinuierlicher Anwendung in der Schwangerschaft mit einer Wirkung auf die Schilddrüsenfunktion gerechnet werden. Auch bei euthyreoter Mutter kann es zu einer fetalen Hypothyreose mit Ausbildung einer Struma und der Gefahr von Komplikationen wie Polyhydramnion, Trachealverlegung kommen.
- Ziel: minimale Thyreostatika-Dosis, fT4 am oberen Referenzbereich (18-20pmol/l), TSH darf supprimiert bleiben
- Kontrolle fT4 alle 2-4 Wochen, bei Erreichen der stabilen Phase alle 4-6 Wochen
- Kontrolle TRAK im 1.Trimenon und in der 22.–26. SSW bei neudiagnostiziertem M. Basedow, jedoch auch bei St. n. Radiojodtherapie, St.n. Schilddrüsenoperation, anamnestisch Kind mit neonataler Hyperthyreose
- Thyreostatika plazentagängig, daher regelmässige sonographische Kontrollen des Feten (Herzfrequenz, Wachstum, fetale Schilddrüsengrösse)!
- Definitive Therapien selten notwendig: Radiojodtherapie kontraindiziert in der Schwangerschaft, Thyreoidektomie falls PTU > 450mg/d oder Carbimazol > 30mg/d, Unverträglichkeit auf beide Thyreostatika, OP am besten im 2. Trimenon.
- Schwangerschaftsinduzierte Hyperthyreose
- Beta-Blocker zur kurzzeitigen symptomatischen Therapie z.B. Propranolol 20–40 mg alle 4–6 h
- keine Langzeitgabe wegen Gefahr intrauteriner Wachstumsretardierung, fetaler Bradykardie und neonataler Hypoglykämie.
- latente Hyperthyreose: keine Therapie indiziert
- Wochenbett: häufig Rezidiv, typischerweise vier Monate nach Entbindung
- Spezialsituation: Euthyreose mit persistierend erhöhten TRAK-Titer. Diese gehen ungehindert durch Plazentaschranke und können beim Feten eine Hyperthyreose machen mit schwerwiegenden Komplikationen. Daher vor Konzeption medizinische Interventionen evaluieren (z.b. Thyreoidektomie).
- Schwangere mit erhöhten TRAK-Konzentrationen sollten bereits früh in der Schwangerschaft in einer Einrichtung mit entsprechender Erfahrung mitbetreut werden. Bei TRAK-Konzentrationen, die die Norm um mehr als das Dreifache überschreiten, soll ein intensiviertes geburtshilfliches Monitoring des Kindes erfolgen.
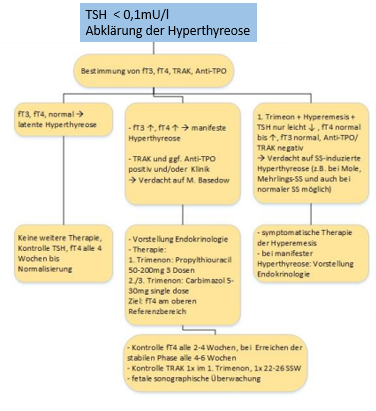
Modifiziert nach Schema TSH in der Schwangerschaft, obsgyn-wiki.ch, Version 12/2020
Erweiterte fetale Diagnostik in der Schwangerschaft
Empfohlen bei:
- Vorliegen von stimulierenden TRAK: Ein Grenzwert von maternalen TRAK im 2. und 3. Trimenon > 5 IU/l (oder > 2–3-fache Erhöhung über dem oberen Grenzwert) hatte in 2 Studien eine Sensitivität von 100% für die Entwicklung einer neonatalen Hyperthyreose. Die Inzidenz einer fetalen/neonatalen Hyperthyreose bei Schwangeren mit Morbus Basedow liegt bei 1–5%. Die kongenitale neonatale Hyperthyreose hat eine Mortalität von bis zu 25%.
- maternale Einnahme von Thyreostatika: regelmäßige Kontrollen durch einen erfahrenen Pränataldiagnostiker zum Ausschluss einer fetalen Hypothyreose (insbesondere einer fetalen hypothyreoten Struma)
Zeichen einer fetalen Hyperthyreose: fetale Tachykardie, fetale Wachstumsrestriktion, fetale Struma, vorzeitige Ossifikationen, kardiale Veränderungen (z. B. Trikuspidalinsuffizienz) und Hydrops fetalis.
Darstellung/Messung der fetalen Schilddrüse aus Hamza A. et al., Recommendations of the AGG (Working Group for Obstetrics,Department of Maternal Diseases) on How to Treat Thyroid Function Disorders in Pregnancy, 2023:
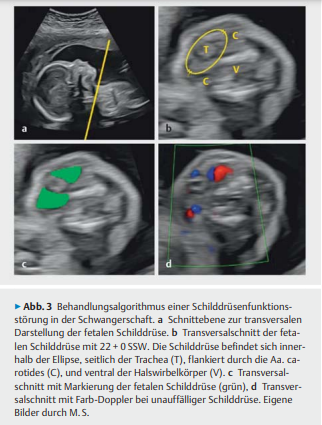
- Eine fetale Struma kann sowohl im Rahmen einer fetalen Hyperthyreose bei maternalen TRAK wie auch bei fetaler Hypothyreose durch maternale thyreostatische Therapie entstehen.
- Als Merkmal einer hyperthyreoten Struma wird die zentrale Perfusion im Ultraschall beschrieben, im Gegensatz zur peripheren Perfusion, die häufiger bei hypothyreoten Strumata gefunden wird.
Häufigkeit
- Prävalenz: nach 5-8% aller Schwangerschaften, (hohe Variabilität in den Studien, 1-16.7%)
- Bei Diabetes mellitus Typ 1: 3-4 faches Risiko für PPT
Klinik
- Destruktions-Hyperthyreose: Unterform chron. Autoimmun-Thyreoiditis
- TPO-AK meist positiv
- Euthyreose vor- und während der Schwangerschaft
- Auftreten innerhalb des 1. Jahres nach Geburt
- Hyperthyreote Phase meist innerhalb der ersten 2-6 Monate nach Geburt
- Wahrscheinlichkeit erneuter PPT bei weiteren Schwangerschaft: 70%
Therapie
- Keine kausale Therapie, Thyreostatika unwirksam
- Evt. symptomatische Betablocker-Gabe in hyperthyreoter Phase
- Substitution bei manifester hypothyreoter Phase
- TSH Kontrolle alle 4-8 Wochen
- Bei T4- Substitution: evt. Absetzversuch nach 12 Monaten postpartal unter TSH- Kontrollen
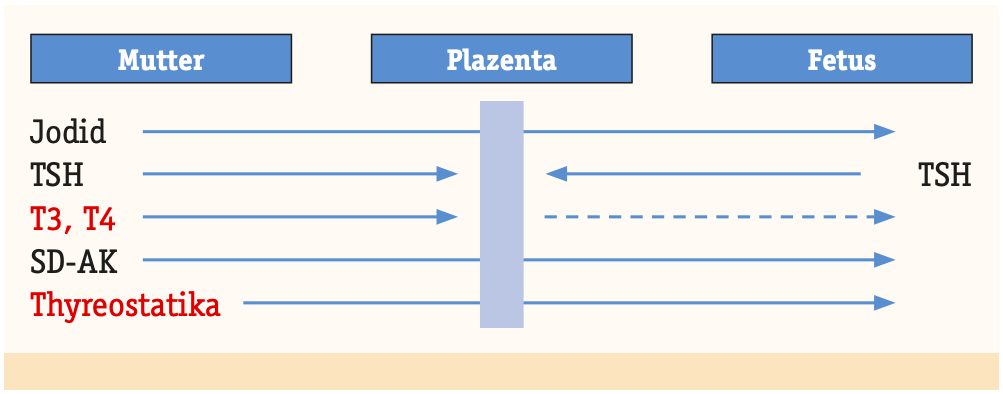
Cave: partielle Inaktivierung T4 in rT3 und T3 in T2 via Deiodinase Typ III
Zeichen für Hyperthyreose/Thyrotoxikose:
- Tachykardie/Arrhythmie, Tachypnoe, Hyperthermie Unruhe, Zittrigkeit, Schwitzen, Struma, Diarrhö, Dehydratation, Gedeihstörung, Hyperbilirubinämie, Kraniosynostose, Wachstumsretardierung
Zeichen für Hypothyreose beim Neugeborenen:
- muskuläre Hypotonie, Trinkschwäche, Obstipation, grosse Fontanellen, Makrosomie, Myxödem, Hyperbilirubinämie, Bradykardie, Markoglossie, Nabelhernie, kühle und trockene Haut
Abalovich M et al (2010) The relationship of preconception thyrotropin levels to requirements for increasing the levothyroxine dose during pregnancy in women with primary hypothyroidism. Thyroid20:1175–1178
Abeillon-du Payrat J, Chikh K, Bossard N et al. Predictive value of maternal second-generation thyroid-binding inhibitory immunoglobulin assay for neonatal autoimmune hyperthyroidism. Eur J Endocrinol 2014; 171:451–460. doi:10.1530/EJE-14-0254
Alexander EK, Pearce EN, Brent GA et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017; 27: 315–389. doi:10.1089/thy.2016.0457
Anderson et al.: Maternal Thyroid Function in Early Pregnancy and Neuropsychological Performance of the Child at 5 Years of Age. JCEM 2018 103 (2). 660-670
Ballabio et al., Pregnancy-induced changes in thyroid function: role of human chorionic gonadotropin as putative regulator of maternal thyroid. J Clin Endocrinol Metab. 1991;73(4):824
Benker G. et al., Schilddrüse und Schwangerschaft -Update 2023, Frauenheilkunde up2date 2023; 17 (3): 281-297, D01: 10.1055/a-1710-8889
Bojunga J. et al. Schilddrüse und Schwangerschaft J. Gynäkol. Endokrinol. CH 2021 24:82–92 https://doi.org/10.1007/s41975-021-00196-x
Dong et al.: The Need for Dynamic Clinical Guidelines: A Systematic Review of New Research Published After Release of the 2017 ATA Guidelines on Thyroid Disease During Pregnancy and the Postpartum. Frontiers in Endocinology 2020, 11:193
Du et al., Preconception TSH and adverse pregnancy outcomes in China: a nationwide prospective cohort study. J Clin Endocrinol Metab 2022; 107: e2770-e2776. Doi: 10.1210/clinem/dgac208
Hales C et al.: Controlled antenatal thyroid screening II: effect of treating maternal suboptimal thyroid function on child cognition. J Clin Endocrinol Metab 2018 Jan 15. doi: 10.1210/jc.2017-02378.
Hamza A. et al., Recommendations of the AGG (Working Group for Obstetrics,Department of Maternal Diseases) on How to Treat Thyroid Function Disorders in Pregnancy, Geburtsh Frauenheilk 2023; 83: 504–516, DOI 10.1055/a-1967-1653
Keck Ch. Schilddrüse und Schwangerschaft. Frauenarzt. 2019; 8: 510-15
Krull. I. Hyperthyreose vor/während/nach Schwangerschaft. Endokrinologie Kolloquium 22.05.2019
Lazarus JH et al.: Antenatal thyroid screening and childhood cognitive function. NEJM 2012; 366(6): 493-501
Maraka et al., Thyroid hormone treatment among pregnant women with subclinical hypothyroidism: US national assessment. BMJ 2017;356: i6865.doi: 10.1
Nguyen CT, Sasso EB, Barton L et al.: Graves' hyperthyroidism in pregnancy: a clinical review: Clin Diabetes Endocrinol. 2018; 4:4
Peleg D, Cada S, Peleg A et al. The relationship between maternal serum thyroid-stimulating immunoglobulin and fetal and neonatal thyrotoxicosis. Obstet Gynecol 2002; 99: 1040–1043. doi:10.1016/s0029-7844(02)01961-0
Unuane D. et al., 2020, Impact of thyroid disease on fertility and assisted conception. Best pract Res Clin Endocrinol Metab 34:101378
Van Diik et al., Levothroxine in euthyroid thyroid peroxidase antibody positive womenwith recurrent pregnancy loss (T4LIFE trail): a multicenter, randomized, double-blind, placebo-controlled, phase 3 trail. Lancet Diabetes Endocrinol 2022; 10:322-329
Verhagen NJE, Gowachirapant S, Winichagoon P et al. Iodine Supplementation in Mildly Iodine-Deficient Pregnant Women Does Not Improve Maternal Thyroid Function or Child Development: A Secondary Analysis of a Randomized Controlled Trial. Front Endocrinol (Lausanne)2020; 11: 572984. doi:10.3389/fendo.2020.572984
Wang et. Al.,Effect of Levothyroxine on Miscarriage Among Women With Normal Thyroid Function and Thyroid Autoimmunity Undergoing In Vitro Fertilization and Embryo Transfer, A Randomized Clinical Trial, JAMA. 2017;318(22):2190-2198. doi:10.1001/jama.2017.18249
Weiss JW: Schilddrüse und Kinderwunsch. Gynäkologie und Geburtshilfe. 2018; 2: 6-9
Weiss JW: Schilddrüseneinstellung bei Kinderwunsch und in der Schwangerschaft. Gynäkologische Endokrinologie. 2019; 1:20–24
Zhang Y, Wang H, Pan X et al. Patients with subclinical hypothyroidism before 20 weeks of pregnancy have a higher risk of miscarriage: A systematic review and meta-analysis. PLoS One 2017; 12: e0175708.doi:10.1371/journal.pone.0175708
Autor: L. Gabriel, V. Uerlings
Überarbeitet: S. Brylski
KSW Version: 1.0, 01/2024
